(2)电解质料无水氯化镁可由海水制备.主要有以下过程:①在必定条件下脱水枯燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶.
(5)饱满NH4Cl溶液滴入少数的Mg(OH)2悬浊液中,看到的现象是.反响原理可能有两方面,请分别用离子方程式表明:①;②.
要验证①②谁是Mg(OH)2溶解的根本原因,可选取替代NH4Cl溶液刁难照试验.
(6)镁电池是近年来科学技术研究的热门之一.一种“镁-次氯酸盐”电池的总反响为:
Mg+ClO-+H2O═Mg(OH)2+Cl-.其作业时正极的电极反响式:;用此镁电池给铅蓄电池充电,下列说法中正确的是.
C.充电后,铅蓄电池南北极质量均减小,理论上镁电池耗费24gMg,阴、阳极的质量改变之比为3:2
(2)先生成氢氧化镁,氢氧化镁和盐酸反响生成氯化镁,易除掉氯化钠等杂质;
(6)依据正极得电子产生复原反响书写;依据充电时正极充任阳极,负极充任阴极来剖析.
(3)依据(2)的剖析,过程①中“必定条件下”详细是指在HCl气流中加热晶体,意图避免加热时水合氯化镁晶体水解,故答案为:在HCl气流中加热晶体;避免加热时水合氯化镁晶体水解;
悬浊液中,呈现的现象是白色沉积溶解;硝酸铵、硫酸铵和氯化铵类似,只要铵根离子的水解,而碳酸氢铵溶液呈碱性,只要醋酸铵呈中性而且含有铵根,故答案为:白色沉积溶解(或溶液变弄清);①NH
(6)一种“镁-次氯酸盐”电池的总反响为:Mg+ClO-+H2O═Mg(OH)2+Cl-.其作业时正极是ClO-得电子产生复原反响的反响,所以正极的电极反响式为:ClO-+2e-+H2O=Cl-+2OH-;用此镁电池给铅蓄电池充电,
C.充电后,铅蓄电池南北极质量均减小,理论上镁电池耗费24gMg即搬运2mol电子,所以阴极生成是铅、阳极生成是二氧化铅的质量改变之比为3:2,故C正确;
D.充电后,镁电池的PH值根本没改变和铅蓄电池生成硫酸故pH减小,故D过错;
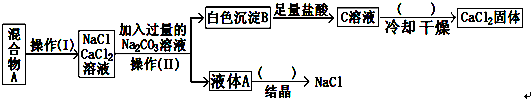
(3)按此试验计划得到的NaCl固体中必定含有(填化学式)杂质;未处理这个问题能够向操作(Ⅱ)得到的液体A中参加适量的;反响的方程式为:.
(2)滴定管如图2所示,用滴定管盛装规范浓度的氢氧化钠溶液(填“甲”或“乙”).
(3)如图1表明某次滴守时,滴定管中前后液面的方位.由图可知该次所用规范浓度的氢氧化钠溶液体积25.00mL(填“大于”、“小于”或许“等于”).
(2)要除掉某食盐晶体中的CaCl2、MgCl2、Na2SO4等杂质,有以下操作:
A、蒸腾结晶B、过滤C、参加过量的Na2CO3溶液D、加水溶解 E、参加过量的烧碱溶液F、参加过量稀盐酸G、参加过量的Ba(NO3)2溶液H、参加过量的稀硝酸I、参加过量的BaCl2溶液
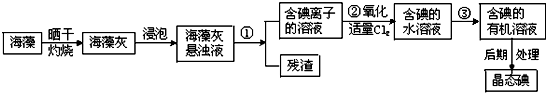
Ⅱ.海洋植物如海带、海藻中富有丰厚的碘元素,碘元素以碘离子的方式存在.试验室里从海藻中提取碘的流程如图所示:
(3)为使海藻灰中碘离子转化为碘的有机溶液,试验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持、衔接仪器和物品,尚短少的玻璃仪器是.
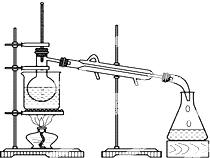
(4)从含碘的有机溶液中提取碘和收回有机溶剂,还需通过蒸馏.设备如图所示.
①核算所用浓硫酸的体积 ②量取必定体积的浓硫酸③稀释④搬运 ⑤洗刷⑥定容⑦摇匀
(4)以下状况对所制造的稀硫酸浓度有何影响?(用字母填写a.偏大b.偏小c.无影响)
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少数水使液面凹面与刻度线相切
(5)本试验最荒度时刻的当地是将稀释后的硫酸冷却至室温,为了节省时刻,简单易行的加速稀硫酸冷却的办法是.




镁是一种重要的金属资源 发表时间:2025-01-19
来源:理论学习





 闽公安备案 闽ICP备16038609号 备案号
闽公安备案 闽ICP备16038609号 备案号